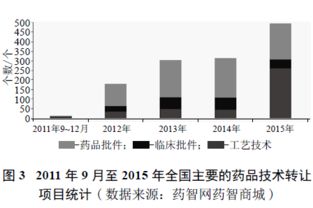
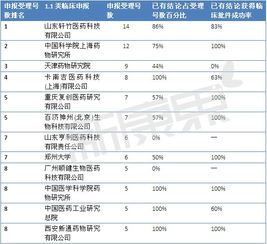
中國藥品監管體系經歷了一場深刻的變革,尤其是藥品注冊審評制度的改革,極大地重塑了醫藥行業的生態環境。其中,藥品技術轉讓作為連接研發與市場、優化資源配置的關鍵環節,在這一輪改革浪潮中,既迎來了前所未有的發展機遇,也面臨著必須正視的嚴峻挑戰。
一、 改革帶來的新機遇
- 審評提速與路徑清晰化為轉讓“鋪路”:新制度下,藥品審評審批時限大幅壓縮,審評標準與國際接軌,流程更加透明、可預期。這為技術轉讓后的產品上市進程注入了“強心針”,縮短了投資回報周期,增強了轉讓方與受讓方的信心。特別是對于臨床急需、具有明顯臨床優勢的藥品,通過優先審評、附條件批準等新通道,技術轉讓成果能夠更快惠及患者,提升了轉讓的價值和吸引力。
- 上市許可持有人(MAH)制度釋放核心紅利:MAH制度的全面實施,是本次改革的核心亮點之一。它允許研發機構、科研人員等非生產企業持有藥品上市許可,從根本上解除了技術轉讓中“捆綁”生產資質的傳統束縛。技術持有方可以更靈活地選擇最具成本優勢或技術優勢的生產企業進行委托生產,實現了研發與生產的專業化分工。這極大地激活了研發端的創新活力,使得“輕資產”的研發型公司或高校院所的成果能夠更順暢地通過技術轉讓實現產業化,技術轉讓的市場空前活躍。
- 鼓勵創新的政策導向提升技術價值:改革強調以臨床價值為導向,鼓勵具有真正創新性的藥品研發。對于擁有突破性技術、改良型新藥或高技術壁壘仿制藥(如首仿藥)的項目,其技術價值在市場上得到更高認可。這使得優質技術成果在轉讓時議價能力更強,吸引了更多資本和產業方關注,推動了高質量技術轉讓交易的發生。
- 全生命周期監管強調持續責任:新的監管體系強調對藥品全生命周期的管理。這促使技術轉讓雙方必須更審慎地評估技術的成熟度、質量可控性以及后續變更管理的能力。從長遠看,這規范了技術轉讓市場,有利于那些數據扎實、工藝穩健、質量管理體系完善的技術成果脫穎而出,獲得長期合作的優勢。
二、 改革伴隨的新挑戰
- 技術評估標準提高,門檻水漲船高:審評標準與國際接軌,意味著對技術資料(CMC)、臨床數據、藥理毒理研究等的要求更加嚴格和細致。一項擬轉讓的技術,其研究數據的完整性、合規性和科學性將面臨更苛刻的審視。任何歷史研究數據的缺陷或不足,都可能成為轉讓過程中的“硬傷”,大幅增加后續補充研究的成本和時間,甚至導致轉讓失敗。
- 轉讓過程中的責任界定與風險共擔更復雜:MAH制度下,持有人對藥品的全生命周期質量承擔主體責任。在技術轉讓時,原研方(轉讓方)與受讓方(常常成為新的MAH)之間關于技術資料轉移的完整性、工藝知識傳遞的準確性、以及上市后不良反應監測、變更管理、質量缺陷追溯等責任的劃分,需要極其清晰和嚴謹的法律與技術合同約定。責任界定不清將成為未來重大風險源。
- 監管持續性與變更管理挑戰加劇:藥品獲批上市并非終點。技術轉讓后,任何生產場地、工藝、標準等的變更都需要進行充分的研究、評估和報批。在新的監管框架下,變更管理要求更為系統化。受讓方是否具備理解和執行原工藝、并有效管理后續變更的技術與管理能力,是轉讓成功的關鍵。轉讓方能否提供持續的技術支持,也成為一個重要考量因素。
- 市場競爭加劇對轉讓策略提出新要求:審評提速導致藥品上市競爭愈發激烈,市場窗口期可能縮短。這就要求技術轉讓的決策和落地執行必須更加高效。受讓方在選擇引進技術時,不僅要評估其科學和法規可行性,還需前瞻性地進行市場分析,確保轉讓產品在未來激烈的市場競爭中具有足夠的商業價值。
三、 應對策略與展望
面對機遇與挑戰并存的局面,參與藥品技術轉讓的各方需積極調整策略:
- 對轉讓方(如研發機構、創新公司)而言,應立足于研發源頭,秉承高質量研發的標準,建立完整、合規、可轉移的數據包。在轉讓前,提前進行法規符合性自查和差距分析。在協議中,明確劃分各階段責任,并考慮提供一定期限的技術支持服務。
- 對受讓方(如制藥企業)而言,需建立強大的技術評估和盡職調查能力,不僅要“買技術”,更要評估自身是否具備“接得住、管得好”該技術的全生命周期管理能力。應加強自身質量管理體系和變更管理體系建設。
- 對雙方而言,技術轉讓不再是“一錘子買賣”,而應著眼于建立基于長期質量共治、利益共享的戰略合作伙伴關系。充分利用合同研發生產組織(CDMO)等專業外包資源,可以分散生產環節的風險與壓力。
中國藥品注冊審評制度改革為藥品技術轉讓開辟了更廣闊、更規范的發展空間,但同時也樹立了更高的專業標桿。唯有那些深刻理解新法規內涵、注重技術質量與全周期責任、并能構建穩固合作關系的參與者,才能在這場變革中把握機遇、化解挑戰,最終通過高效的技術轉讓,推動創新成果轉化,助力中國醫藥產業的高質量發展。